Tabla periódica de los elementos. Breve reseña.
Antes de llegar a la tabla periódica actual, se pasó por muchas otras clasificaciones.
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características.
La primera clasificación de elementos conocida fue elaborada por el químico francés Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias tanto en las propiedades físicas como químicas de los elementos agrupados.
Todos los beneficios, en un solo lugar Descubrí donde te conviene comprar hoy
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
A continuación, algunos nombres de científicos, según el aporte que realizaron en la ordenación de los elementos hasta llegar a la tabla periódica actual.
Dobereiner. Clasificó los elementos en tríadas.
Newland. Colocó los elementos en orden creciente a sus masas atómicas y notó que las propiedades se repetían cada ocho elementos.
Mendeleiev. Colocó los elementos en orden creciente a sus masas atómicas.
Moseley. Colocó los elementos en orden creciente a sus números atómicos.
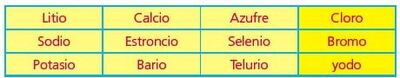
Tríadas de Döbereiner
Uno de los primeros intentos para agrupar los elementos fue propuesto por el químico alemán Johann Wolfgang Döbereiner, quien en 1817 agrupó dichos elementos según sus propiedades análogas y los relacionó con los pesos atómicos, con lo que puso en evidencia el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último.
En su clasificación, Döbereiner expuso que el peso atómico promedio de los pesos de los elementos extremos es parecido al peso atómico del elemento del medio. Por ejemplo, para la tríada cloro, bromo, yodo, los pesos atómicos son, respectivamente, 36, 80 y 127; si sumamos 36 + 127 y dividimos entre dos, obtenemos 81, que es aproximadamente 80 y, si le damos un vistazo a nuestra tabla periódica, el elemento con el peso atómico aproximado a 80 es el bromo, lo cual hace que concuerde un aparente ordenamiento de tríadas. Hacia 1850, los químicos habían llegado a identificar unas veinte tríadas. Se descartó agruparlos de esta forma, porque se descubrieron nuevos elementos que no cumplían con las tríadas.
Ley de las octavas de Newlands
El químico inglés John Alexander Newlands, en 1864, comunicó los resultados que obtuvo al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno). Es así como pudo deducir que el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero.
Esta ley revelaba un cierto grado de ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en periodos formados por ocho elementos cuyas propiedades iban variando progresivamente.
Debido a que a partir del calcio esta regla deja de cumplirse, esta ordenación no fue apreciada por la comunidad científica.
Próxima semana: Tabla periódica actual.
Actividades
Establecé diferencias entre los aportes de Lavoisier, Döbereiner y Newlands en la construcción de la tabla periódica. Determiná las limitaciones de sus clasificaciones.