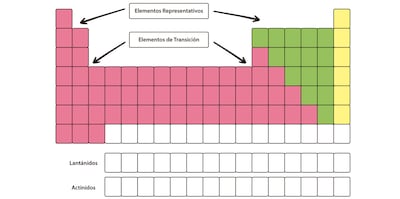
Los grupos: son 18 en total, y se subdividen en elementos representativos (o grupo A) y elementos de transición (grupo B).
Elementos representativos o del grupo A: se caracterizan por culminar su configuración electrónica en los subniveles s y p. Los elementos representativos tienen la particularidad de poseer cantidad de electrones conforme al número de grupo, siendo en total:
Grupo I A – Metales alcalinos: agrupa elementos que poseen un solo electrón en su último nivel. A excepción del hidrógeno, son todos metales alcalinos (sodio, litio, potasio,rubidio, ceso, francio).
Grupo II A – Metales alcalinotérreos: poseen dos electrones en su último nivel.
Todos los beneficios, en un solo lugar Descubrí donde te conviene comprar hoy
Grupo III A – Familia del boro (boroides): poseen tres electrones en su último nivel.
Grupo IV A - Familia del carbono o carbonoides: poseen cuatro electrones en su último nivel.
Grupo V A – Familia del nitrógeno o nitrogenoides: Poseen cinco electrones en su último nivel.
Grupo VI A – Familia del oxígeno, oxigenoides o calcógenos: poseen seis electrones en su último nivel.
Grupo VII A – Halógenos: poseen siete electrones en su último nivel.
Grupo VIII A o grupo cero – Gases nobles o inertes: poseen ocho electrones en su último nivel.
Lea más: Tabla periódica o sistema periódico (2)
Elementos de transición o del grupo B: se caracterizan por culminar su configuración electrónica en el subnivel d. Se ubican en el centro de la tabla, y están comprendidos, además, por un grupo de elementos conocidos como «de transición interna». Estos se ubican en dos líneas horizontales en la parte inferior de la tabla periódica, y tienen la particularidad de culminar su configuración electrónica en el subnivel f: son los actínidos y lantánidos.
Los periodos
Son siete en total, pues indican la cantidad de niveles de energía o número de órbitas que tienen los átomos de los elementos que allí se ubican. Esto determina que los átomos de los elementos ubicados en el primer periodo de la tabla poseen un solo nivel de energía, o una sola órbita; también que los átomos de los elementos que se ubican en el segundo periodo poseen dos órbitas o dos niveles de energía, y así sucesivamente mientras se aumenta el periodo.
Los elementos de la tabla
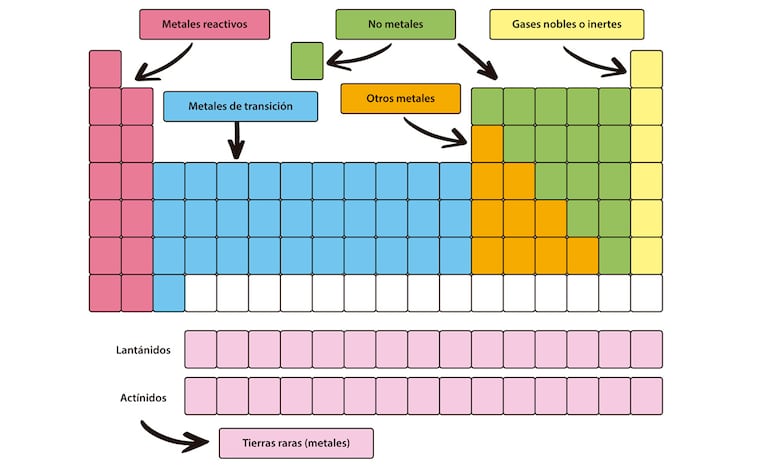
Según sus características se pueden clasificar en: metales, no metales, metaloides o semimetales, con características intermedias a los metales y no metales y los gases nobles, poco reactivos y muy estables.
Los símbolos químicos… pueden representarse con una letra mayúscula o con un par de letras (La primera escrita con letra mayúscula y la segunda con letra minúscula). Ejemplos O (oxígeno), Ag (plata) por su nombre en latín argentum.
Capacidad
Analiza la organización de la tabla periódica.
Fuentes: https://bit.ly/3L0fcep. Arandu ABC. 2015.